Асоциация на имунни комплекси. Механизми за дисоциация на антитяло-антиген
Наскоро един общ механизъм на сдружаване и дисоциация комплекси като антитяло-антиген или ензим - инхибитор, като се вземат предвид динамичните свойства на протеина и взаимодействието му с вода. В случай на имуноглобулини се счита, че активния център и други IgG неполярен кухина между вариабилни и константни домени на Fab-фрагменти между субединиците на IgG и между домейните на Fc-фрагменти могат рязко се движат от "отворен" състояние на "затворено" и обратно, с обем или сорбция на определено количество вода.
съответните промени вода свойства се считат като преход в близост до фазата на първия вид (т.е.. д., без промяна в свободната енергия, но с рязка промяна на енталпията, ентропия и топлинен капацитет). По този начин предполага висока степен на ред на водните молекули в отворени и протеинови кухини строги изисквания към геометрията и свойствата на кухините в това състояние.
Разликата в водни свободните енергии, разположена в отворена кухина в нарушено състояние и квази-кристален, наречен clusterophilic взаимодействие.
асоциация епитоп активния център придружено от разрушаване на подредени структура вода и изместване му в външната среда. Отворено състояние, когато това се дестабилизира и затвори - се стабилизира чрез нековалентни връзки с активното детерминанта сайт. Дисоциацията е обратния процес.

По този начин, максимален скорост на асоциация константа К + л се определя от честотата на преминаване на активното място от отворено към затворено. Ако вземем К + 1 ~ 108 М-1s-1, това означава, че съгласно Айринг уравнение свободна енергия за активиране на прехода на около 6.5 ккал / мол активното място.
Смята се, че между кухини държавни протеин съществува взаимодействие. Следователно, бързи промени в динамичното поведение на активния център чрез действието на антиген индуцира процес на релаксация, което води до сходни промени в характера на колебания останалите IgG кухини. Този процес е придружен от увеличаване на свързващата константа на лиганда, протеин стабилността и компактността на.
получено изразяване, свързване на скоростта на асоциация и дисоциация на свързващите константи със скорости на преход на активния център и други кухини антитяло от затворено състояние в отворено, и обратно. Последиците, произтичащи от тях, са в добро съгласие с експерименталните данни.
имуноглобулини до сега се превърне в един от най-старателно проучени протеини и по този начин да представлява много удобен инструмент за по-нататъшни изследвания на техните свойства и функции, както и познаване на протеин допринася физиката като цяло.
в областта на генетичните изследвания регулиране биосинтеза на имуноглобулини доведе до принципно нови открития от първостепенно значение не само за имунологията, но също така и за молекулярна биология и генетика. Следната статия се занимава с организацията на генетичния материал, който контролира образуването на полипептидни вериги на имуноглобулини в бозайници.
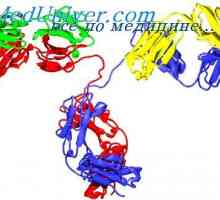 Класове имуноглобулини. Структурата на вериги на имуноглобулина
Класове имуноглобулини. Структурата на вериги на имуноглобулина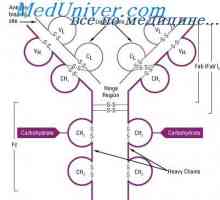 Структурата на активните центрове на антитела. Изследването на активните места на имуноглобулини
Структурата на активните центрове на антитела. Изследването на активните места на имуноглобулини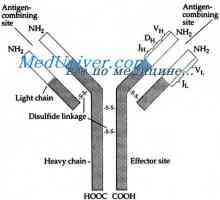 Имуноглобулин център гр. Активен център IgG
Имуноглобулин център гр. Активен център IgG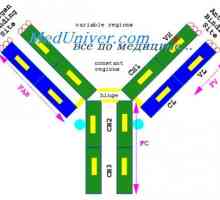 Имуноглобулин структура грама. домейни IgG
Имуноглобулин структура грама. домейни IgG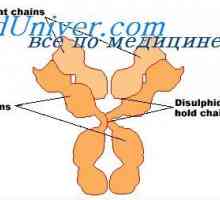 Свойства на антитела активни центрове. реактивност на имуноглобулини
Свойства на антитела активни центрове. реактивност на имуноглобулини Гъвкавост на имуноглобулин г и д. Гъвкавостта на видове имуноглобулини
Гъвкавост на имуноглобулин г и д. Гъвкавостта на видове имуноглобулини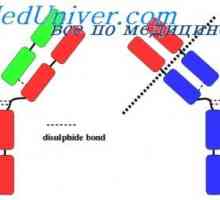 Поляризацията на флуоресценцията метод антитяло. корелация на имуноглобулин
Поляризацията на флуоресценцията метод антитяло. корелация на имуноглобулин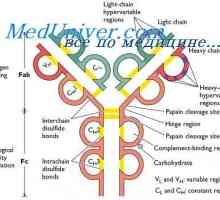 Промени в антителни молекули. В структурата на имуноглобулин
Промени в антителни молекули. В структурата на имуноглобулин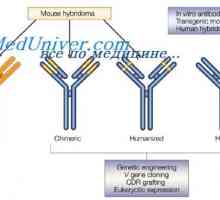 Модификация на антитяло след реакция с антигена. допълни центрове
Модификация на антитяло след реакция с антигена. допълни центрове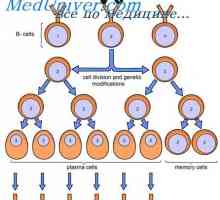 Стабилизиране на имуноглобулини хаптени. Зависимостта на конформацията на антитялото на…
Стабилизиране на имуноглобулини хаптени. Зависимостта на конформацията на антитялото на…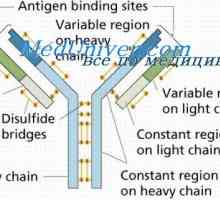 Утайката имунни комплекси. Взаимодействие домени на антитяло вериги
Утайката имунни комплекси. Взаимодействие домени на антитяло вериги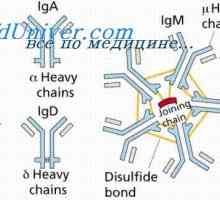 Konformennaya модел на имунни комплекси. Взаимодействие на антитела с антигени
Konformennaya модел на имунни комплекси. Взаимодействие на антитела с антигени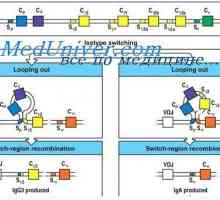 Синтезът на имуноглобулини. образуване на антитела
Синтезът на имуноглобулини. образуване на антитела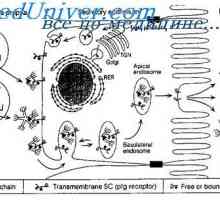 Мембранните имуноглобулини. повърхностно антитяло
Мембранните имуноглобулини. повърхностно антитяло Инхибиране на производство на антитела. Синтез антитела на обратна връзка
Инхибиране на производство на антитела. Синтез антитела на обратна връзка Хуморални инхибитори антитяло. Натрупване на инхибитори на синтеза на антитела
Хуморални инхибитори антитяло. Натрупване на инхибитори на синтеза на антитела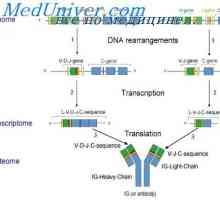 Антитяло отговор. Ролята на макрофаги в индуцирането на антитяло
Антитяло отговор. Ролята на макрофаги в индуцирането на антитяло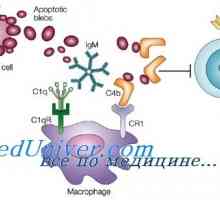 Миелоидните дендритни клетки. Фоликуларен тумор-асоциирани дендритни клетки
Миелоидните дендритни клетки. Фоликуларен тумор-асоциирани дендритни клетки Активираните Т-клетки. Антиген-представящи клетки
Активираните Т-клетки. Антиген-представящи клетки Т-лимфоцити. Характеристики на Т-лимфоцити. Видове молекули по повърхността на Т-лимфоцити.
Т-лимфоцити. Характеристики на Т-лимфоцити. Видове молекули по повърхността на Т-лимфоцити. Функция в клетки. Видове молекули върху повърхността на лимфоцитите.
Функция в клетки. Видове молекули върху повърхността на лимфоцитите.