Разпределението на убиквитин-протеазомна пътека протеин
Повечето (80-90%) вътреклетъчен протеин разбивка извършва убиквитин-протеазомна пътека. Пътят на убиквитин-протеазомна присъства в ядрото и цитоплазмата на еукариотни клетки и играе важна роля в разграждането на нормални и анормални протеини. Този път е отговорен за контролирано разграждане на много протеини, включително тези, необходими за контрол на растежа и клетъчна пролиферация, клетъчна диференциация, имунни и възпалителни отговори, апоптоза и метаболитна адаптация.
Пътят на убиквитин-протеазомна също носи "икономически" функция главно от протеин циркулация и елиминиране на анормален протеини с грешен кодиране, неправилно усукани локализиран в не-основни области, повредени или взети друго от действие. Пътят на убиквитин-протеазомна играе критична роля в контрола на мускулна маса, и неговата активност се повишава в кахексия. Този път също играе значителна роля за възстановяването на мускулите и ремоделиране.
Пътят на убиквитин-протеазомна Това може да се разглежда като последователност от три процеса:
(1) признаване на протеин субстрат на гниене на;
(2) ковалентно прикрепване на полиубиквитиновите вериги като протеин маркер за гниене;
(3) протеолиза 2500 кД протеинов комплекс, наречен 26S протеазомата.
признаване протеин, предназначени за разлагане обикновено се извършва:
(1) съгласно някои структурни промени на протеина, включително ефектите върху последователност специфична амино киселина, която е скрита в нормалните пост-транслационни модификации, такива като фосфорилиране или хидроксилиране;
(2) за свързване или освобождаване на неговите лиганди;
(3) взаимодействие с адапторен протеин или придружител (например, износ неправилно нагънат протеини чрез чаперони в цитозола на EPR);
(4) специфичен щетите срещащи се в протеина чрез окисление или nitrosylation.
В допълнение, наличието на специфичен "дестабилизиращ"Остатъци Л-крайна част на пептид марка предназначен за разцепване (т.е., с кратък полуживот). Въпреки това, следва да се отбележи, че преди да се подложи на разделяне, не всички протеини, произведени убиквитин маркер.
За разлика от това, някои протеини са отцепване от 20S основен протеазома. Целта на този модел е ясно разделяне, но изглежда, че трябва да се случва с протеини, които имат ясно неструктурирани региони, които дават по-голяма нестабилност на протеина.

Първата реакция - активиране на убиквитин Е1 (ubikvitinaktiviruyuschim ензим) и след това доставя убиквитин Е2 (ubikvitinprisoedinya yuschemu-ензим).
Втората реакция - образуване на комплекс с Е2, ЕЗ (убиквитин свързващ ензим) и субстрат.
Третата реакция - прехвърляне на убиквитин лизин (-АМИНО) субстрат, субстратът за отбелязване полиубиквитинов верига. В резултат на четвъртия етап се отделя от субстрата полиубиквитинов E3.
Накрая, субстрат протеазома разгъва АТР-зависим начин от активността на ubikvitingidralazy разделя убиквитин верига и вмъква разгъната протеин в камерата за протеазома са порции където протеазна активност. Молекулите на убиквитин се рециклира, докато получените пептиди са разделени на аминокиселини и използва отново за синтезата на нов протеин.
Ub - убиквитин.
След протеин се идентифицира като субстрат на разграждане, тя е снабдена с ковалентно белязан убиквитин. Убиквитин - протеин присъства във всички видове клетки и се състои от остатъци от 76 аминокиселини, включително С-терминален глицин и лизинов остатък в позиция 48. убиквитин е ковалентно свързан с протеин, предназначени за разграждане в серия от три реакции, катализирани от ензими, известни като Е1 (ubikvitinaktiviruyuschy ензим), Е2 (ubikvitinprisoedinyayuschy ензим) и E3 (ubikvitinsvyazyvayuschy ензим).
там Две изоформи Е1, Няколко изоформи на Е2 и Е3 е много голям брой ензими, което позволява специфични субстрати на много тъкани и регулиране на този процес.
първата молекула убиквитин активиран чрез свързване на АТР-зависим реакцията на Е1, и след това се прехвърля към убиквитин Е2 фрагмент. И Е1 и Е2 са активните места на цистеинови остатъци, които формират тиоестери с С-терминален глицин остатъка на убиквитин. Накрая, убиквитин присъедини към Е2 се предава директно или чрез вътрешната E3 lizilovomu остатък на протеин субстрат.
E3 играе важна роля в признаването протеин субстрат за разцепване и в регулирането на образуване субстрат комплекс E2 / E3. По подобен начин допълнително убиквитин молекули са прикрепени към субстрат с един прикрепен убиквитин молекула, образувайки изопептидна връзки между С-терминалния глицин остатъка на убиквитин молекула и лизинът се намира в позиция 48 преди добавя убиквитин молекулата.
необходима верига най-малко четири молекули на убиквитин до протеини няколко молекули маркирани убиквитин лесно се разпознават и са насочени към 26S протеазома разцепване. Наскоро проучване беше свързващите домени на активност и убиквитин. Важно е, че процесът на убиквитиниране е обратимо, с присъствието на процес изключване, което се случва клас на цистеин протеази, наречени deubikvitiniruyuschimi ензими.
дейност deubikvitiniruyuschego ензим Това е да се елиминират свързване към убиквитин, убиквитин обработка прекурсор, свързващ убиквитиновите вериги и повторно използване на убиквитин. Тези процеси са отговорни за регулирането на няколко сигнални пътища, които са важни за процеса на развитие, включително клетъчния растеж и диференциация.
действителната разграждане на протеини убиктинивират възниква във вътрешната камера на протеазомата, но молекулите на убиквитин отцепват първия, така че те могат да бъдат използвани, 26S протеазомата е голям, състояща се от няколко подединици на комплекса, който включва субединици 20S като протеолитично ядро с регулаторни 19S сложни свързани към един или двата края. Регулаторни субединици са включени в признаване на белязани белтъци, отстраняване убиквитин маркер, както и АТР-зависимите процеси разгъване на протеина и протеолитично сърцевина в посока, като форма тунел.
протеолитична 20S комплекс е цилиндрично кухо структура, състояща се от четири подредени един върху друг пръстеновидни структури (ABBA), всеки от които е образувана от седем субединици. В централната кухина на каталитична структура се състои от общо шест протеолитични порции формира три различни каталитични субединици всеки б-пръстен. Те се отнасят до каталитично субединици TV-краен треонин gidralazam, както Л-терминални треонин действа като нуклеофилно катализатор. Въпреки това, три различни субединици във всеки от двата пръстена са различни предпочитания в разцепването на пептидни връзки веднага след основни, хидрофобни и киселинни остатъци.
20S субединицата хидролизира входящо субстрата в пептидни фрагменти, състоящи се от 3-30 аминокиселинни остатъци. Тези пептидни продукти се освобождават от протеазомата в клетката и след това се подлагат на хидролиза други протеази и аминопептидази.
регулиране протеолиза в протеазомата се извършва в три нива. Първо, признаването на субстрата е регулируеми функции, определени за целеви протеин poliubikvitinirovaniya на. За повечето протеини са неидентифицирани субстрати и включва фосфорилиране, хидроксилиране на пролин остатък или идентифициране разцепване сигнал съдържа в първичната последователност. Второ, регулирани разграждане на определени класове на субстратите може да се постигне чрез комбиниране на комплексите E2 / EZ с различни спомагателни фактори.
Например, в някои случаи, а именно EZ Това трябва да се промени или "включен" чрез пост-транслационната модификация да неговата активна форма, която разпознава субстрат. В други случаи, стабилността на протеин субстрат зависи от неговата връзка с молекулни чаперони, които действат като елементи за откриване и които служат като връзки с подходящи лигази. По-специално, инсулин намалява убиквитин-протеазомна активност медиирана от вътреклетъчните протеази и движение insulinosnizhayuschego ензим на 20S протеазома и 26S. Накрая, убиквитин-протеазомна може да бъде контролирана или чрез взаимодействие или промени в експресията на убиквитин протеазомни субединици.
Един пример за това може да се наблюдава след Интравенозната инфузия на аминокиселини или след въвеждането им в чревния лумен. Повишена доставка на аминокиселини, но не глюкоза намалява иРНК експресия на убиквитин ubikvitinprisoedinyayuschego ензим с молекулно тегло от 14 Ша, и С9 протеазомна субединица в чревната лигавица.
 Открити ново заболяване на детството - otulipeniya
Открити ново заболяване на детството - otulipeniya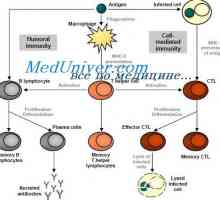 Сигнали дан-подобни рецептори. Ролята на молекула MyD88
Сигнали дан-подобни рецептори. Ролята на молекула MyD88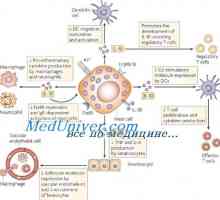 Cross-презентация. Имунният отговор в отсъствието на инфекция
Cross-презентация. Имунният отговор в отсъствието на инфекция Диференциацията на Т и В клетки. Цитокините индуцират диференциация на клетки от Th1 тип и от типа…
Диференциацията на Т и В клетки. Цитокините индуцират диференциация на клетки от Th1 тип и от типа…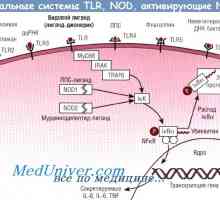 Ефект на чревни бактерии от своя възпалителен отговор
Ефект на чревни бактерии от своя възпалителен отговор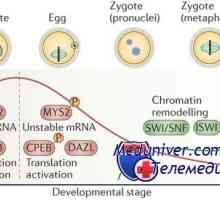 Майчините гени ефект. Кодиране на протеини на ооцита
Майчините гени ефект. Кодиране на протеини на ооцита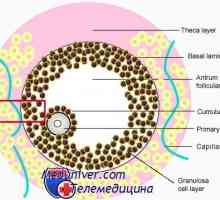 Признаци на готовност за незрялата яйцеклетка мейоза. Разтварянето зародишен везикули (т)
Признаци на готовност за незрялата яйцеклетка мейоза. Разтварянето зародишен везикули (т) Състоянието на чревните епителни имунитета при недоносени деца
Състоянието на чревните епителни имунитета при недоносени деца Механизми гниене и катаболизъм на протеините в организма
Механизми гниене и катаболизъм на протеините в организма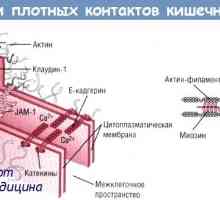 Чревната силно съединителна структура, структура
Чревната силно съединителна структура, структура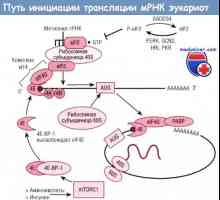 Пътят за започване на иРНК превод по време на синтеза на протеини
Пътят за започване на иРНК превод по време на синтеза на протеини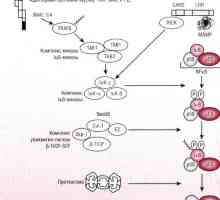 Патогенеза начин NFkB / относителен в реакция на бактериите на чревния епител
Патогенеза начин NFkB / относителен в реакция на бактериите на чревния епител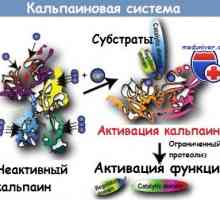 Kalpainovaya система протеолиза
Kalpainovaya система протеолиза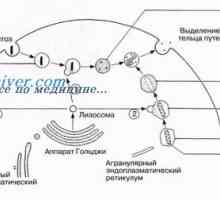 Autofagalno-лизозомна система на апоптоза протеин разцепване
Autofagalno-лизозомна система на апоптоза протеин разцепване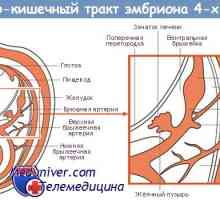 Генетична регулиране на образуването на червата тръбичка
Генетична регулиране на образуването на червата тръбичка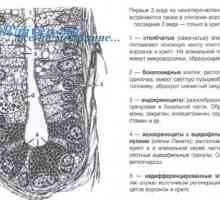 Значение Wnt сигнален път в регулацията на чревни стволови клетки
Значение Wnt сигнален път в регулацията на чревни стволови клетки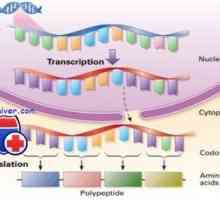 Регулирането на транскрипция и транслация в яйцеклетката
Регулирането на транскрипция и транслация в яйцеклетката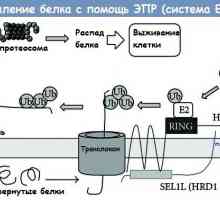 Отцепването на протеина чрез ендоплазмения ретикулум (ER) ERAD система
Отцепването на протеина чрез ендоплазмения ретикулум (ER) ERAD система Антиоксидантен Броколи може да се лекува progeria?
Антиоксидантен Броколи може да се лекува progeria? Onkologiya-
Onkologiya- Onkologiya-
Onkologiya-