Основните химични компоненти на живите организми. различни фактори,
Видео: Структура и свойства на живите организми. Живите се различава от не zhyvogo
Разграничаване физически (температура, налягане, механични въздействия, ултразвук и йонизиращо лъчение) и химически (тежки метали, киселини, основи, органични разтворители, алкалоиди) фактори, причиняващи денатуриране. Всички тези техники са широко използвани в технологията на храните и биотехнологиите. Обратният процес е ренатуриране, т.е. възстановяване на физически, химически и биологични свойства на протеина. Понякога е достатъчно, за да се отстранят за денатуриране обекта. Ренатуриране е невъзможно, ако засегнатите първичната структура.В вода протеини формират колоидни разтвори. Тези разтвори се характеризират с висок вискозитет, способността да се разпръсне видими светлинните лъчи. Колоидни частици няма да преминат през полупропускливата мембрана (целофан, колоиден филм), тъй като техните пори малки колоидни частици. Непроницаема протеин са всички биологични мембрани. Този имот протеинови разтвори обикновено се използват в медицината и химията за пречистване на протеинови препарати от примеси. Такъв процес на отделяне, наречен диализа.
Най-важно свойство на протеини е тяхната способност да проявяват както киселинни и основни свойства, т.е., да действа като амфотерни електролити. амфотерни свойства е основа на буферни свойства на протеини и тяхното участие в регулирането на рН на кръвта. РН на човешка кръв и характеризиращ постоянството е в 7,36-7,4 въпреки различни вещества киселинен или основен характер редовно от храна или произведени в метаболитни процеси. Следователно, има специфични механизми за регулиране на киселина-основа баланс на вътрешната среда.
Протеините се свързват с вода, т.е. проявяват хидрофилни свойства. Когато те се подуват, увеличаване на тяхната маса и обем. Способността на протеините да набъбне за да образуват желета, стабилизиране на суспензии и емулсии на пяна е от голямо значение в хранително-вкусовата промишленост и биологията. Много подвижен желе изработена предимно от протеинови молекули е цитоплазмата - полутечни клетъчно съдържание. Силно хидратирана желе - суров глутен екстрахира от пшенично брашно, че съдържа до 65% вода.
Функциите на протеини са изключително разнообразни. Всичко това протеин като вещество с определена химическа структура изпълнява високо специализирани функции и само в някои отделни случаи - няколко взаимосвързани. Например, надбъбречната медула хормон епинефрин, влизайки в кръвта се увеличава консумацията на кислород и кръвното налягане, кръвната захар и стимулира обмяната на веществата, както и като медиатор на нервната система в студенокръвни животни.
Основните видове протеини predstavdeny в следната фигура:

Фиг. 2. Основните видове протеини
Подробна проверка на функциите на протеин далеч надхвърля обхвата на това ръководство. Стоп само за ензимна (каталитично) функция. Многобройни биохимични реакции в живите организми протичат при меки условия при температури близо до 40 ° С и рН стойности, близки до неутрално. При тези условия скоростта на поява на повечето реакции са незначителни, така специални биологични катализатори, подходящи за прилагането им са необходими - ензими (Fermentum - дрожди) или ензими (enzume - в дрожди).
Обикновено, ензими - е или протеини или протеинови комплекси с всички коензима метални йони или органична молекула. Ензими имат висока специфичност по отношение на субстрата, т.е. до съединение, което те се ускори трансформация. Ефикасността на ензимите е особено зависи от няколко фактора: температура (оптимална температура 30-50 ° С), в присъствието на активатори или инхибитори, рН на средата. Контакт на ензима с субстрат става чрез активното място. Обикновено, една малка част от молекулата на ензим, в която две отделни зони: свързващи и каталитично. Структурата на активния център са отделни части от веригата на полипептид и кофактори.
В момента има общо около 3000 различни ензими, те са разделени в 6 класа.
1. оксидоредуктази, или редокс ензими (дехидрогенази, оксидази, редуктази, трансхидрогеназа хидроксилаза). Те катализира окислението или намаляване на различни химически вещества.
2. трансферази. Представители на тази група от ензими катализират трансфера на различни групи от една молекула на друг, например, фосфорилиране, трансаминиране. Те включват, например, трансаминаза.
3. хидролази (пептидази, естерази, гликозидази, фосфатази). Тези ензими разграждат протеини, мазнини и въглехидрати чрез хидролиза. Играят особено важна роля в храносмилането и в хранителни технологии.
4. лиази. Катализират реакцията на разцепване между въглеродните атоми, С-С и О-С и С и N- Hal. За тази група от ензими, включва, например, декарбоксилаза С02 молекула отцепва от органични киселини.
5. изомерази (рацемаза, епимеразни). Катализират структурни промени в една молекула на органично съединение.
6. лигази (синтетази). Катализират образуването на С-О, C-S, C-N, С-С.
В допълнение към протеини, сред безкрайно разнообразие от химически вещества, от които са изградени живи организми, специално място се заема от друг тип биологични полимери - нуклеинови киселини. В ролята на мономери действа в този случай нуклеотиди. Нуклеотидна се състои от три компонента: пуринова или пиримидинова база, пет въглеродни циклични uglevodaDstroenie въглехидрати и свойства са обсъдени по-долу), `която база е свързан с един от неговите азотни атоми N-гликозидна връзка (образувани нуклеозид) (фосфат и отнасящ естерната връзка с 5` въглехидрат-въглерод.
При образуването на нуклеиновите киселини може да включва две групи от нуклеотиди - рибонуклеотиди и дезоксирибонуклеотиди. Първата форма рибонуклеинова киселина (РНК), последният - ДНК. В ДНК, има четири вида нуклеотиди, които се различават само азотни основи. Тези основи са две пурин (PU) - аденин (А) и гуанин (G) - и две пиримидин (Ру) - тимин (Т) и цитозин (С). Характерна особеност на ДНК е, че молекулата си се състои от два полимерни вериги, усукани в двойна спирала (Фигура 2).
Всяка верига - редовен полимер, в който въглехидрат остатъци на две съседни нуклеотиди, свързани с помощта на фосфатни групи. В тази връзка, образование винаги присъстват 5`- фосфат на един нуклеотид и хидроксилната 3`- друг. Следователно, въглехидрати фосфат гръбнака на молекулата е с правилна структура, където 3`, 5`- фосфодиестерна връзка на молекулата е най-чувствителните към химически, така и ензимно разцепване.
За разлика от въглехидрати фосфатен скелет, последователността на пуринови и пиримидинови бази, по веригата е много неравномерен, всеки специфичен тип ДНК молекула се характеризира с определена последователност. Двете вериги са държани заедно чрез водородни връзки между базови двойки. Аденин винаги двойки с тимин и гуанин - с цитозин. Стриктното допълване причинява специфичност свързване, т.е. взаимно съвпадение в базовите последователности на две вериги.
Принципът на допълване се формулира и доказано D. Watson и Crick през 1953 принцип rtot е един от основните връзки в създаването на пространствената структура на ДНК, изградени от два допълващи се нишки. Такава структура се нарича дуплекс. Принципът на допълване осигурява архивиране информация за единична верига от нуклеотиди в последователност, комплементарна на друга верига.
Ето защо, ако на две родителски дуплекс са разделени верига, всеки от тях е в състояние да управлява изграждането на мономерите на комплементарната верига, което води до възстановяване на двете дуплекси, които са идентични с оригинала. Въпреки това, последователността на нуклеотиди във всяка верига - това е само чертеж за създаване на нови ДНК молекули. За изграждането на нови вериги трябва адекватно снабдяване на мономерите, и специално устройство, което изпълнява последователно добавяне на нови мономери на нарастващата полимерна верига.
Тези устройства са ензими, наречени ДНК полимерази. Процес на синтез на комплементарна ДНК верига дъщеря на една от веригите се нарича родителски репликация. След създаването на структурата на ДНК се формулира идея на генетичния код, който е как ДНК молекула аминокиселинни последователности са написани програмиран си протеини. Директен монтаж протеини от аминокиселини ДНК не контролира.
Това прави РНК, която се синтезира с помощта на ДНК. РНК се състои от четири нуклеотиди са обозначени с буквите А G, С и U (РНК урацил вместо тимин включени). Химически, те са много близки до нуклеотидите, образуващи ДНК и поддържа селективни партньори на взаимодействие. Синтезът на нови молекули РНК с помощта на RNA полимераза. Последният стимулира транскрипция, в които ДНК, съответстваща на част съдържаща информация за определена последователност от аминокиселини съответства на определена последователност на кодиращи елементи, изработени от рибонуклеотиди. По този начин, информацията, вградени в ДНК молекулата се предава с помощта на специален агент (пратеник от английски език. "пратеник" - пратеник) - иРНК (информационна РНК, РНК).
Нови полипептидни вериги се синтезират върху специални дупрамолекулните структури - рибозомите. Всяка рибозом съдържа няколко РНК молекули -ribosomnyh РНК (иРНК) и други протеини. Синтез на протеини, наречени превод на рибозомите. Освен иРНК и рРНК има трети тип РНК - транспортна РНК (тРНК) - необходими участници процес превод. Репликация, транскрипция и транслация - трите стълба на процеса, който се основава на никакви жизнени функции.
SV Макаров, TE Никифоров, NA Козлов
Споделяне в социалните мрежи:
сроден
 Ефектът на ултразвук (САЩ) на плода. ехографски биофизика
Ефектът на ултразвук (САЩ) на плода. ехографски биофизика Определенията в ембриологията. Концепцията за развитие в ембриология
Определенията в ембриологията. Концепцията за развитие в ембриология Първа помощ при изгаряния, горят заболяване
Първа помощ при изгаряния, горят заболяване Първа помощ, диализа и филтриране кръв методи
Първа помощ, диализа и филтриране кръв методи Секрецията на вода и електролити в стомашно-чревния тракт. Физиология на слузта на стомашно-чревния…
Секрецията на вода и електролити в стомашно-чревния тракт. Физиология на слузта на стомашно-чревния… Вторични и третични структура на имуноглобулини. Изследването на структурата на имуноглобулини
Вторични и третични структура на имуноглобулини. Изследването на структурата на имуноглобулини Повърхностно ефекти на газовите мехурчета. Ефектът на газови мехурчета на липопротеини
Повърхностно ефекти на газовите мехурчета. Ефектът на газови мехурчета на липопротеини За транспортни протеини на клетъчната мембрана. Дифузия през клетъчната мембрана
За транспортни протеини на клетъчната мембрана. Дифузия през клетъчната мембрана Нови наночастици за хипертермия в онкологията
Нови наночастици за хипертермия в онкологията За лечение на остър хемодинамичен HMC. Основните параметри
За лечение на остър хемодинамичен HMC. Основните параметри Биологични обекти в областта на биотехнологиите
Биологични обекти в областта на биотехнологиите Основните химични компоненти на живите организми
Основните химични компоненти на живите организми Сушилня в биотехнологичната промишленост
Сушилня в биотехнологичната промишленост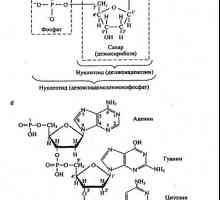 Основните химични компоненти на живите организми. липиди
Основните химични компоненти на живите организми. липиди Обща информация за радиоактивното разпадане и йонизиращите лъчения
Обща информация за радиоактивното разпадане и йонизиращите лъчения Изгаряния на очите възникнат при излагане на висока температура (термични изгаряния) или химикали…
Изгаряния на очите възникнат при излагане на висока температура (термични изгаряния) или химикали… Голям Медицински Енциклопедия IC nevronet. наркотици
Голям Медицински Енциклопедия IC nevronet. наркотици Хематология-трансфузиология (кръвопреливане)
Хематология-трансфузиология (кръвопреливане) Една стъпка по-близо до органична електроника
Една стъпка по-близо до органична електроника Намерено гъби, абсорбираща пластмаса
Намерено гъби, абсорбираща пластмаса Кърлежи - най-упорити животни
Кърлежи - най-упорити животни