Регламент и разстройства на алкално-киселинното равновесие
Видео: Neumyvakin киселина-база баланс
Съдържание
- Видео: neumyvakin киселина-база баланс
- Физиология на киселинно-алкалния баланс
- Киселина-база баланс
- Видео: киселинно-алкалния баланс на професора по тялото алкализирането безразборно
- Видео: патофизиология на въглехидратния метаболизъм (Лекция). t.n.0 alhendi. част 1/2
- Нарушение на алкално-киселинното равновесие
- Видео: Учените са установили, регулатор на алкално-киселинното равновесие

В процеса на метаболизъм непрекъснато оформен киселини и основи.
водороден йон (Н +) е особено reaktiven- се свързва с отрицателно зареден влакна и, ако присъства във висока концентрация, се променя тяхната обща заряд, конфигурация и функция. Следователно механизми съществуват в организма се поддържа концентрацията на Н + в тесен диапазон - 37-43 нмол / L. Нарушаването на тези механизми може да има тежки клинични последствия.
Киселина-база баланс е тясно свързано с водно-електролитния obmenom- нарушение на един от тези обикновено засяга друга.
Физиология на киселинно-алкалния баланс
Повечето от киселини, образувани по време на метаболизма на въглехидрати и мазнини, по време на който ежедневно произведени от 15 000 20 000 ммола CO2. Сама по себе си, CO2 киселина не е, но взаимодейства с вода (Н2О) кръв, се превръща в карбонова киселина (Н2CO3). На последно място, в присъствието на ензима карбоанхидраза дисоциира +НСО3-. Н+ Той се свързва с хемоглобина в червените кръвни клетки и се освобождава при окисляване на кръвта в белодробната алвеолите, където обратната реакцията протича за образуване на Н2О и CO2- CO2 отделя по време на всяко издишване.
Малки количества от органични киселини се образуват от:
- непълна метаболизъм на глюкоза и мастни киселини (превръщането им в млечна и кето киселини);
- метаболизма на сяра-съдържащи аминокиселини (цистеин, метионин), за да се образува сярна киселина;
- метаболизма на положително заредени аминокиселини (аргинин, лизин);
- хидролиза на фосфати, консумирана храна.
Това "фиксирана", или натоварване метаболитна киселина не се появява в дишането и следователно или трябва да се неутрализира или се екскретира през стомашно-чревния тракт и бъбреците.
Повечето от основата се произвежда по време на метаболизма на анионни аминокиселини (глутамат и аспартат) и консумацията на органични аниони, такива като лактат и цитрат, която се образува по време на окисляването на НСО3-.
Киселина-база баланс
Киселина-база баланс да се поддържа чрез химически системи буфериращи и екскреция на излишните киселини или основи чрез белите дробове и бъбреците.
Видео: киселинно-алкалния баланс на професора по тялото алкализирането безразборно
Химическа буферни системи. Системата за химически буфериране - този разтвор затихване промени в рН. Intra - и извънклетъчни буферни системи веднага да реагират на нарушаване на алкално-киселинното равновесие. Важен буфер функция се изпълнява и костите. Буферната система се състои от слаба киселина и свързаната с него база. Основата отдава Н+, слаба киселина е изключен и по този начин намалява промяната в концентрацията на свободен Н+.
Увеличаването на концентрацията на предстоящото полето уравнение, т.е. Той произвежда повече CO2. Концентрацията на CO2 контролирани вентилирани алвеоли, и концентрацията на Н+ и НСО3- бъбречна екскреция.
Връзката между ДДС3- и СО2 системата може да се опише чрез уравнение Касирер - Bleich получен уравнения на Henderson - Felix Gasselich-Balho: Н+= 24hPCO2/ ДДС3-
Това уравнение показва зависимостта на алкално-киселинното равновесие на връзката PCO2НСО3-, а не абсолютните стойности на всеки показател. Използвайки тази формула, стойностите за всеки две индекси (обикновено Н+ и РСО2) Може да се изчисли трета стойност (обикновено НСО3-).
Видео: патофизиология на въглехидратния метаболизъм (Лекция). T.N.0 Alhendi. част 1/2
Други важни физиологични буферни системи включват вътреклетъчни органични и неорганични фосфати, както и протеини, включително хемоглобин. Екстрацелуларните фосфати и плазмени протеини в това отношение играят по-малка роля. Костите стават буфер, абсорбиращ извънклетъчния НСО3-. В началото те бяха в замяна на Н+ освобождаване карбонат Na (NaHCO3)3) И калиев карбонат (KHCO3), и когато вече кисела натоварване - карбонат Са (СаСОз3) И фосфат Са (CaPCO4). Поради това, в дългосрочен план acidemia придружен от деминерализация на костите и остеопороза.
белодробна регулиране. Концентрацията на CO2 плътно регулира приливен обем и дихателната честота (минутна вентилация). Намалена рН възприема артериална и хеморецептори води до увеличаване на дихателен обем или дишане честота. Това увеличава издишване CO2 и по този начин повишава рН на кръвта. За разлика от химически системи буфериращи, които реагират бързо на промените в рН, белодробна регулиране се извършва в рамките на няколко минути или часове. Неговата ефективност варира от 50 до 75%, и не е напълно нормализира рН.
бъбречна регулация. Бъбреците контрол на рН чрез промяна на реабсорбцията на НСО3- и отделяне на Н+- забавяне ДДС3- еквивалентен на броя на изход свободен Н+.
реабсорбция ДДС3- Това се случва най-вече в крайните каналчета и събиране на канали. Тръбните клетките H2На дисоциира на Н+ и хидроксид (ОН-). Под действието на карбоанхидраза ОН- Той се свързва с СО2, формиране на ДДС3-, която се транспортира обратно към перитубуларната капилярите, а Н+ секретира в лумена на тубуларни и там е свързан към свободно филтрува ДДС3-, формиране CO2 и Н2О, които са също предмет реабсорбция. Така йони се реабсорбират НСО3- - тези, които се образуват отново, а не тези, които се филтруват през гломерулите. Намалена ефективен обем циркулация (както се случва, когато получаване диуретици) подобрява реабсорбцията на НСО3-, докато увеличаването на нивата на паратироиден хормон в отговор на киселина натоварване намалява реабсорбция на този йон. За да се засили реабсорбцията на НСО3- също води до увеличаване на РСО2, и намаляване Cl- (Обикновено поради хиповолемия) повишава повторното абсорбиране на Na+ ДДС и образование3- в нефрони.
Н+ активно секретират в лумена на проксималните и дисталните тубули, който е свързан с урината на буферни съединения - предимно свободно филтрува HPO4-2, креатинин, пикочна киселина и амоняк - и отделя. Амониев буферна система играе особено важна роля, тъй като други буферни съединения филтруват при фиксирани концентрации и тяхното съдържание може да се намали при натоварвания високи киселина. За разлика от продуктите на амоняк активно регулирани тръбни клетки в отговор на промени в киселина натоварване. Секрецията на киселина зависи преди всичко от рН на артериалната кръв, но също така се влияе от нивата K+, Cl- и алдостерон. секреция на Н+ и вътреклетъчната концентрация на К+ са в реципрочни отношения: намаляване на K+ Това повишава секрецията на Н+ и, следователно, насърчава развитието на метаболитна алкалоза.
Нарушение на алкално-киселинното равновесие
Нарушение на киселина-основа промени баланса включват PCO2 артериалните нива на НСО кръвни3- в серум и серум рН.
Видео: Учените са установили, регулатор на алкално-киселинното равновесие
- Acidemia - рН суроватка <7,35.
- Alkalemiya - рН суроватка >7.45.
- Ацидоза е причинена от физиологични процеси, придружени от натрупване на киселини или основи загуба.
- Алкалоза се причинява от физиологични процеси, придружени от натрупване или загуба на базовите киселини.
действителните променя рН зависят от степента на компенсация на физиологични разстройства на алкално-киселинното равновесие и зацепване компенсация множество процеси.
класификация
Основни разстройства на алкално-киселинното равновесие се разделят на метаболизма и респираторна зависимост от клинични прояви и дали промените на рН са свързани главно с промените в нивото на НСО3- или PCO2 серум.
Метаболитна ацидоза - концентрацията на НСО3- серум <24 мэкв/л.
Причини:
- повишено образуване на киселини;
- киселина консумация;
- намалена бъбречна екскреция киселини;
- загуба на НСО3- през стомашно-чревния тракт или бъбреците
Метаболитен алкалоза - концентрацията на НСО3- серум >24 милиеквивалента / л.
Причини:
- загуба на киселини;
- забавяне НСО3-.
Дихателна ацидоза - РСО2 >40 mm Hg. Чл.
причина:
- намаляване в минутна вентилация (gipovengilyatsiya).
Респираторна алкалоза - РСО2 <40 мм рт.ст.
причина:
- увеличаване минутна вентилация (хипервентилация).
Когато е налице нарушение на алкално-киселинното равновесие, компенсаторни механизми започват да се регулира рН. Компенсацията не осигурява пълното нормализиране на рН и никога не е прекомерна.
Симптоми и признаци
Клиничните прояви на компенсирани или белодробни заболявания на алкално-киселинното равновесие са оскъдни, а тежките некомпенсирани промени имат много сърдечносъдови, дихателни, неврологични и метаболитните последствия.
диагностика
Определяне на ВСС и електролити в серума. Определяне на ВСС позволява направим рН и РСО2. Нивото на НСО3- изчислена съгласно уравнението Henderson-Gasselbalha- за анализ серум химия може да бъде директно и по-точно определяне на това ниво. Най-точна оценка на алкално-киселинното равновесие, като правило, могат да бъдат получени чрез измерване на рН и PCO2 е артериална кръв. Въпреки това, с циркулаторна недостатъчност или Реанимация венозни кръвни параметри по-точно да отразяват киселина-база баланс на нивото на тъкан, и може да се направлява в оценката на адекватността на бикарбонат терапия или вентилация.
РН стойности характеризират първоначалния дефект (ацидоза или алкалоза), въпреки че тези процеси компенсаторни променени до нормални стойности. промени РСО2 отразява дихателните компонент, и променя НСО3- метаболитна.
Все пак, за да се реши дали промените ПКЯ2 и НСО3- основно и по-компенсаторна и дали е налице смесен нарушение може да се наложи в някои vychisleniya- смесени заболявания на определения може да бъде измамно нормално. Следователно е необходимо да се вземе предвид клиничните данни при тълкуването измерване и изчисляване на резултатите (например, хронични белодробни заболявания, бъбречна недостатъчност, редица лекарства предозиране).
Винаги се изчисли количеството на анионното празнина. Увеличаването почти винаги показва метаболитна ацидоза. Нормално празнина анион с ниска НСО3- и висока концентрация на Cl- серум показва не-анионна (хиперхлоремична) метаболитна ацидоза. Метаболитна ацидоза делта анионна разлика се изчислява за откриване едновременно метаболитна алкалоза и Winter формула използва за определяне дали адекватна компенсация дишане или отразява второто нарушение на алкално-киселинното равновесие.
 Характеристики на течно-електролитния баланс при предоставянето на спешна медицинска помощ
Характеристики на течно-електролитния баланс при предоставянето на спешна медицинска помощ Първа помощ за лактатна ацидоза
Първа помощ за лактатна ацидоза Първа помощ в случай на отравяне с концентрирани киселини и разяждащи алкален
Първа помощ в случай на отравяне с концентрирани киселини и разяждащи алкален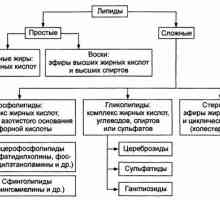 Свободни мастни киселини. Транспорт свободни мастни киселини
Свободни мастни киселини. Транспорт свободни мастни киселини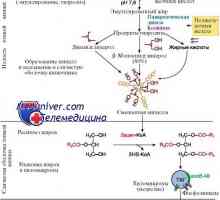 Образованието в черния дроб ацетоацетат. Кетоза време на гладно и пристрастяване към мазни храни
Образованието в черния дроб ацетоацетат. Кетоза време на гладно и пристрастяване към мазни храни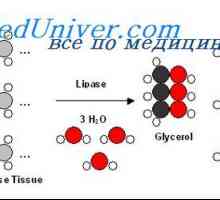 Триглицеридите синтеза на протеини. Регламент на енергия освобождаване на триглицеридите
Триглицеридите синтеза на протеини. Регламент на енергия освобождаване на триглицеридите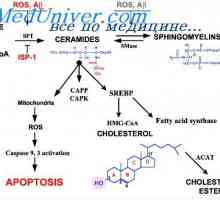 Фосфолипиди и техния обмен. Физиология Холестерол образование
Фосфолипиди и техния обмен. Физиология Холестерол образование Чернодробна система на макрофагите. Метаболитен чернодробна функция
Чернодробна система на макрофагите. Метаболитен чернодробна функция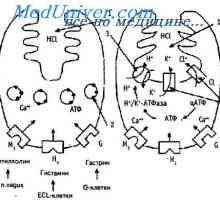 Стомашна солна киселина. Функции на солна киселина в стомаха.
Стомашна солна киселина. Функции на солна киселина в стомаха.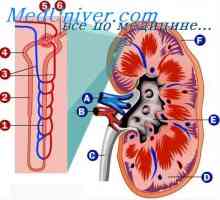 Бъбречна физиология. Регулирането на водно-електролитния баланс
Бъбречна физиология. Регулирането на водно-електролитния баланс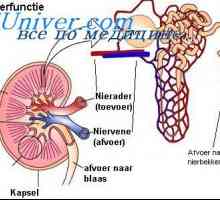 Алкално-киселинното равновесие. Регулирането на концентрацията на водородните йони
Алкално-киселинното равновесие. Регулирането на концентрацията на водородните йони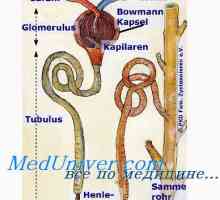 Поддържането на концентрацията на водородните йони. Функция на буферни системи
Поддържането на концентрацията на водородните йони. Функция на буферни системи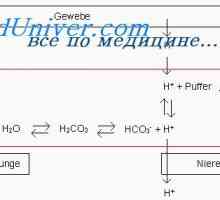 Henderson-Hasselbach уравнение. буферен резервоар
Henderson-Hasselbach уравнение. буферен резервоар Силни и слаби киселини и основи. Концентрацията на водородни йони и рН
Силни и слаби киселини и основи. Концентрацията на водородни йони и рН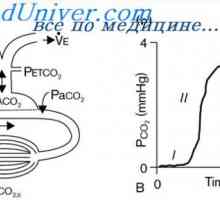 Капацитетът на буфер на дихателната система. Участие в бъбречната регулиране на киселинно-алкалното…
Капацитетът на буфер на дихателната система. Участие в бъбречната регулиране на киселинно-алкалното…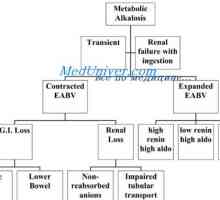 Оценка на разстройства на алкално-киселинното равновесие. смущения смесен киселинен баланс
Оценка на разстройства на алкално-киселинното равновесие. смущения смесен киселинен баланс Ацидоза и алкалоза
Ацидоза и алкалоза Методи за определяне на състоянието на алкално-киселинното равновесие
Методи за определяне на състоянието на алкално-киселинното равновесие Методически аспекти. Диагностична оценка на функционални системи. хомеостаза Функционална…
Методически аспекти. Диагностична оценка на функционални системи. хомеостаза Функционална… Въглеродният диоксид. Транспорт на въглероден диоксид.
Въглеродният диоксид. Транспорт на въглероден диоксид. Изгаряния гърлата обикновено се наблюдават в резултат на злополука, като у дома си. При възрастни,…
Изгаряния гърлата обикновено се наблюдават в резултат на злополука, като у дома си. При възрастни,…