Поддържането на концентрацията на водородните йони. Функция на буферни системи
Видео: Създаване на дезинфекционни станции басейн Basic ePool.ru
там Три основни системи, които са насочени към регулиране на съдържанието на Н + йони в течна среда, предотвратяване ацидоза или алкалоза: (1) буферираща система на телесни течности незабавно реагира химически с киселина или основа, предотвратяване на промяна в съдържанието на Н + йони - (2), системата дишане, дихателния център, който контролира отстраняването на светлина CO2 (оттук Н2СО3) на извънклетъчния zhidkosti- (3) бъбрек, които са способни да освобождават кисела или алкална урина, така компенсиране в състояние да разработи ацидоза или алкалоза.
при промени съдържанието на буферни системи протонни за части от секундата правят корекции за изглаждане на последиците от такива интервенции. Буферните системи не отстраняват протони и не увеличават тяхното съдържание в тялото, те се свързват Н +, докато се възстанови киселина-алкален баланс.
Вторият "защитници"Служи за дихателната система, който след няколко минути може да се получи от организъм на СО2, и следователно Н2СО3.
Първите две "линия на защита", за да се предотврати развитието на значителни промени в съдържанието на Н + йони, а бавните механизми трета система - отделителните - не елиминират прекомерно съдържание на киселини или основи. В сравнение с други системи, бъбреците са бавно (няколко часа или дни), но тяхната ефективност при поддържане на киселинно-алкалното равновесие е много по-висока.
буфер Това по всяко вещество, способно на обратимо свързване към протони. Общата схема на реакции буфер е както следва: Буфер + Н <=> Н Буфер
В този пример, между свободните протон Той комуникира с буфер съединение за образуване на слаба киселина (буфер Н), където протон може да остане в свързана форма, или отново дисоциира. С увеличаване на концентрацията на Н + йони, реакцията се измества надясно, докато намаляване - наляво. Чрез този механизъм, промени в съдържанието на Н + йони в течна среда ниска.
Значение буферни системи за организма може да се разбира като се вземе предвид, че въпреки образуването рамките на един ден относително високо количество на киселинни продукти, концентрацията на Н + йони в течната среда остава на ниско ниво. Например, с храна или като резултат на метаболитни процеси дневни форми Xia около 80 милиеквивалента Н + йони, докато концентрация от само около 0.00004 милиеквивалента / л. При липса на буферни системи или абсорбция на организма в стомашно-чревния тракт, като количеството на кисели продукти, трябва да доведе до значителни промени в концентрацията на Н + йони.

Механизмът на действие на системите за буферни поддържане киселина-база баланс може да се илюстрира от най-силните от тях - бикарбонат буферна система.
Бикарбонат буферна система Той се състои от воден разтвор, който съдържа два компонента: (1) слаба киселина N2SO3- (2) бикарбонат сол, например NaNSOz.
Н2СО3 образува в тялото чрез взаимодействие на СО2 с Н 2О: СО2 + H2O<=> н2со3
Тази реакция без ензим Карбоанхидразата е бавен, придружен от образуването на малки количества Н2СО3. Карбоанхидразата присъства в значителни количества в стената на белодробните алвеоли, където отделянето на СО2, както и в епителните клетки на бъбречните тубули, където въглеродният диоксид реагира с вода, за да образуват Н2СО3.
Н2СО3 дисоциира слабо, образуване на малко количество Н + йони и HCO3: Н2СО3 <=> н+ + нсо3
Вторият компонент на системата - бикарбонат йон - в извънклетъчната течност настъпва предимно под формата на натриев бикарбонат (NaHCC ^). Той почти напълно се дисоциира за образуване HCO3 и Na +: NaHC03 <=> Na+ + HCО3.
В обикновено бикарбонат буферна система е както следва: СО2 + H2O <=> н2со3 <=> н+ + нсо3.
Н2СО3 дисоциира слабо, така че концентрацията на Н + йони освобождава в разтвор е изключително малка.
Ако добавите за ограничаване силна киселина, НС1 например протони, получени с киселина (НС1 -> Н + + СГ), неутрализира HCO3: Н + + HCO3 -> Н2СО3 -> С02 + H2O.
В резултат на това формира повече от Н2СО3, което повишава образуването на СО2 и Н2О. Според реакциите, показани, се вижда, че Н + силна киселина реагира с HCl HCO3- форма слаб Н2СО3 киселина, която се разлага на въглероден диоксид и вода. Излишният CO2 значително стимулира дишането, стимулиране на освобождаването на СО2 от извънклетъчната течност.
Реакции, наблюдавани в обратна посока добавяне към разтвора на буфер силна основа такава като натриев хидроксид (NaOH): NaOH + Н2СО3 -> NaHC03 + Н20
В този случай, на ОН- йон реагира с Н2СО3, които допринасят за допълнителни образователни NPHS ~. По този начин, слаба основа IaNSOz замества силна NaOH. Едновременно с това, има намаление на концентрацията на разтвора на Н2СО3 (защото той реагира с NaOH), което допринася за реакцията и синтез на нови молекули на СО2 карбонова киселина с Н 2О: СО2 + Н 2О -> Н2СО3 -> HCO3- + Н +.
В резултат на това планираното тенденция за намаляване на нивото на СО2 в плазмата, което от своя страна инхибира дихателния център и намалява отделянето на СО2. Има повишено съдържание на HCO3 йони, се компенсира от емисиите на бикарбонат от бъбреците.
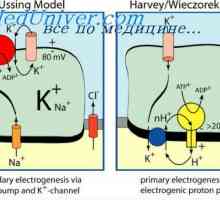 Kontrtransport калциеви и водородни йони. Активен транспорт към тъканите
Kontrtransport калциеви и водородни йони. Активен транспорт към тъканите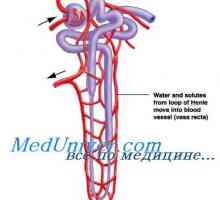 Влияние на ацидоза на калиев обмен. Механизми регулиращи калциев концентрация
Влияние на ацидоза на калиев обмен. Механизми регулиращи калциев концентрация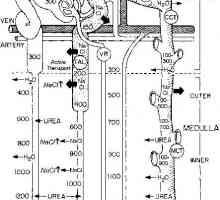 Участие в бъбреците магнезиев обмен. Регулиране на обема на интерстициална течност
Участие в бъбреците магнезиев обмен. Регулиране на обема на интерстициална течност Алкално-киселинното равновесие. Регулирането на концентрацията на водородните йони
Алкално-киселинното равновесие. Регулирането на концентрацията на водородните йони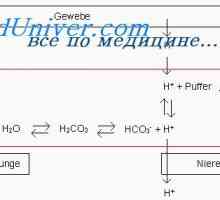 Henderson-Hasselbach уравнение. буферен резервоар
Henderson-Hasselbach уравнение. буферен резервоар Силни и слаби киселини и основи. Концентрацията на водородни йони и рН
Силни и слаби киселини и основи. Концентрацията на водородни йони и рН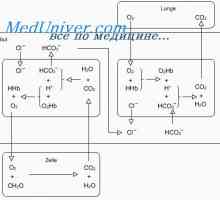 Бикарбонатен буфер система. Системата на фосфатен буфер
Бикарбонатен буфер система. Системата на фосфатен буфер Секреция от протони бъбреците. Реабсорбция на бикарбонатни йони от бъбреците
Секреция от протони бъбреците. Реабсорбция на бикарбонатни йони от бъбреците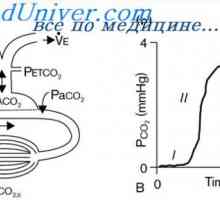 Капацитетът на буфер на дихателната система. Участие в бъбречната регулиране на киселинно-алкалното…
Капацитетът на буфер на дихателната система. Участие в бъбречната регулиране на киселинно-алкалното…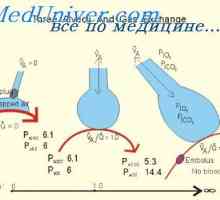 Влияние на алвеоларен вентилация на рН. Ефект на рН на дихателната система
Влияние на алвеоларен вентилация на рН. Ефект на рН на дихателната система Неутрализационни бъбреци протони. Основният механизъм на секреция на активен водород йони бъбрек
Неутрализационни бъбреци протони. Основният механизъм на секреция на активен водород йони бъбрек Зависимостта на секреция от протони бъбреците. Механизми на протонната секреция в бъбречните тубули
Зависимостта на секреция от протони бъбреците. Механизми на протонната секреция в бъбречните тубули Корекция алкалоза бъбреците. Механизми на бъбречната корекция на алкалоза
Корекция алкалоза бъбреците. Механизми на бъбречната корекция на алкалоза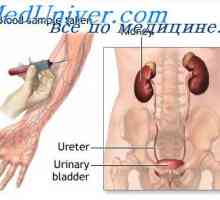 Механизмът на образуване на нови бикарбонатни йони. Фосфатен буфер бъбречната система
Механизмът на образуване на нови бикарбонатни йони. Фосфатен буфер бъбречната система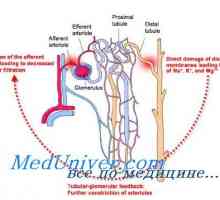 Корекция на ацидоза бъбреците. Механизми за корекция бъбречна ацидоза
Корекция на ацидоза бъбреците. Механизми за корекция бъбречна ацидоза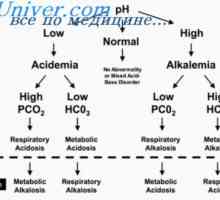 Амониев буферна система. Количествено определяне на киселини и основи разпределение
Амониев буферна система. Количествено определяне на киселини и основи разпределение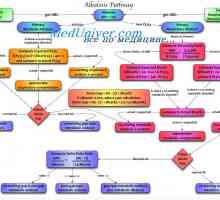 Причините за метаболитна алкалоза. Лечение на ацидоза и алкалоза
Причините за метаболитна алкалоза. Лечение на ацидоза и алкалоза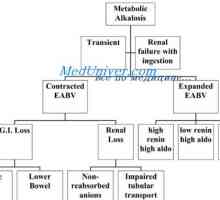 Оценка на разстройства на алкално-киселинното равновесие. смущения смесен киселинен баланс
Оценка на разстройства на алкално-киселинното равновесие. смущения смесен киселинен баланс Активността на дихателния център. Химическа регулиране на дишането
Активността на дихателния център. Химическа регулиране на дишането Ацидоза и алкалоза
Ацидоза и алкалоза Методически аспекти. Диагностична оценка на функционални системи. хомеостаза Функционална…
Методически аспекти. Диагностична оценка на функционални системи. хомеостаза Функционална…