Нови методи за лечение на рак

Съдържание
- Откриването на нови лекарства
- Видео: Ново лечение на рак 34 Канал 26 Февруари 2016 Бизнес програма
- Нови подходи за лъчева терапия
- С гледка лъчетерапия
- Подобряване на външния лъчетерапия лъч
- Подобряване схеми радиотерапия фракциониране
- лъчесензитиращите
- С гледка лъчетерапия
- Видео :. ronts.noveyshie лечение на рака на © ООД "cyber живота"
- Комбинирани терапии
Нови методи за лечение.
Откриването на нови лекарства
По-долу са три основни фактора, за да се стимулира откриването на нови лекарства:
- постигането на едно плато в подобряването на ефективността и терапевтичен индекс на традиционните лекарства;
- появата на нови молекулярни цели в резултат на задълбочаване на нашето разбиране на молекулярните механизми на биологични рак;
- развитие на нови технологии.
Съвременни подходи за разработването на нови лекарства
В момента, все повече и по-склонни към търсенето на молекулни мишени (специфични протеинови продукти от онкогени) и разработване на лекарства, при което, чрез въздействие върху целта, може да се получат желаните промени в биологичната активност или фенотип на туморната клетка (например, инхибиране на пролиферация, клетъчен цикъл, мотилитет , капацитетът за инвазия, ангиогенеза, метастази, и индуцирането на апоптоза и стимулиране на клетъчна диференциация), докато създаването на лекарства, които имат цитотоксично и общо чи tostaticheskoe ефект става по-малко значение.
Този подход се фокусира върху търсенето на нови молекулярни цели, в момента преобладават във фармацевтичната индустрия и биотехнологични компании. Модерният процеса на разработване на нови лекарства, базирани на знания за механизмите на тумор, разделена на няколко етапа.
Определяне на целта и потвърждаването му,
Целта на изследванията в тази стъпка е търсенето на гени и техните протеинови продукти, които са пряко ангажирани в канцерогенезата и туморната прогресия. След като се идентифицират ген са мутирали или прекъснато експресия, провежда експерименти потвърждава, че той наистина е замесен в онкогенезата и фармакологичните ефекти върху него като молекулна мишена може да има анти-туморен ефект.
Идентифицирайте най-обещаващите основни структури на нови лекарства
Целта на тази стъпка - за идентифициране на вещества, които проявяват активност срещу молекулната мишена идентифицирани. За това поведение химически скрининг на различни вещества чрез използване на автоматизиран или висока пропускателна анализ на рационален дизайн на базата на известни субстрати или лиганди.
Оптимизация на основните структури на лекарството
На този етап, "подобряване" основната структура на лекарството, което му желано свойство (например, увеличаване на ефекта разтворимост и селективност) и премахване на нежелани. По този начин се създаде аналози и производни на изходния материал.
Изпитване на нови лекарства в опитите ин виво
Последният етап от развитието на нови лекарства е да се установи дали те са в състояние да предизвикат регресия на трансплантиран човешки тумор на животните или подтисне или забави растежа. В зависимост от биологичното действие на лекарството може да използва по-сложни модели за научни изследвания. Dennym обект за оценка на ефективността на противораковите лекарства са също модели получени в трансгенни мишки.
Обикновено лекарства активност тестват по отношение на ограничен брой тумори, включително човешки тумори преплетени животни. В идеалния случай, молекулни мишени и пътища, които са засегнати 1redstoit с лекарства трябва да бъдат намерени.
Предварително клиничен стадий на разработване на нови лекарства
Избирането на химикали, които могат да се очакват клинично подобрение, извършват редица проучвания.
- Създаване на дозираната форма. Изборът на формата за дозиране повлияе на разтворимостта на химичното вещество, неговата стабилност и дозата.
- Предклинични фармакологично изследване предполага по-подробно изследване на фармакокинетиката, по-специално на абсорбция, разпределение, метаболизъм и екскреция на лекарството.
- Предклинични токсикологично изследване, през който установи естеството на токсичните ефекти и токсичната доза.
заключение
Въпреки значителния напредък в методологията на научните изследвания, процеса на разработване на ново лекарство отнема около седем години след датата на определянето на нови молекулярни цели. Във връзка с очертани отклонение от емпирични скрининг на химични вещества с антитуморна активност и тенденция за търсене на възможни средства на базата на знанията на молекулярните механизми на туморогенезата момента избрани за клинично изпитване на нови лекарства с доста забележителни свойства.
Видео: Ново лечение на рак 34 Канал 26 Февруари 2016 Бизнес програма
клинични изпитвания
Основната цел на фаза I на клинични изпитвания - установяване на безопасността и поносимостта на изследваното лекарство и да се установи оптималната доза и схема заявление за фаза II. В тази фаза също проучване на фармакокинетиката на лекарството вече е в човешкото тяло.
пъти съм
Във фаза I лекарството обикновено се прилага в увеличаване на дозата, и началната доза се определя въз основа на токсикологични изследвания в предклинични изпитания. Началната доза трябва да бъде сравнително ниска, за да се гарантира безопасността на рецепцията, но в същото време е достатъчно висока, за да е възможно да е по-малко от пациентите, получаващи неефективен (твърде ниска) доза.
Верига фаза обикновено се определи максимално поносима доза и доза-ограничаваща токсичност, с изключение на цитотоксични лекарства изпитваното чиято цел може да се определи оптималната активност на лекарството, на базата на неговия механизъм на действие, ако не са предварително открити неприемлива токсичност. Например, може да бъде всеки инхибиране на ензими или намаляване на концентрацията на хормона в кръвната плазма.
След завършване на Фаза I е станал известен спектър големи токсични ефекти на лекарството и дозата, която ще се опита в следващата фаза.
Фаза II и III
Ако лекарството във фазата I са открити токсични ефекти неприемливи, тя преминава фаза II клинични проучвания, както и в случай на успех - фаза III. Целта на фаза II - да се оцени ефективността на лекарството. Всеки тест се извършва във фаза II при пациенти с всяка една тумор получаване на това лекарство в същата доза и същата схема. Заедно с изследването на токсичните ефекти на лекарството също се оценява неговата ефективност. Целта на клиничните изпитвания фаза III - сравни ефикасността на ново лекарство с ефективността на съществуващите лекарства за това заболяване.
Нови подходи за лъчева терапия
Лъчева терапия - ефективен метод за лечение на рак. Повишаването на дозата доставят на тумора, докато защитната съседните здрави тъкани, обикновено се подобри ефективността на местно влияние върху тумора.
Целите на нови подходи към лъчева терапия включват:
- повишаване на дозата, предоставена на тумора;
- подобряване на ефективността на излагане на радиация от използването на лъчесензитиращите;
- използването на различни форми на лъчева терапия за повишаване на своите биологични ефекти;
С гледка лъчетерапия
В основата на селективното действие на лъчева терапия на тумора са биологичните свойства на самия тумор. По принцип, на селективността на действие може да се използва, за да убива раковите клетки, където и да е в тялото, и този подход в момента е в началото на проучването в много тумори.
- Йод - лечение на добре диференциран рак на щитовидната жлеза.
- Моноклонални антитела срещу антигени на клетъчната повърхност - лечение на В-клетъчен лимфом.
- Analog катехоламин прекурсори 13h-MIBG (мета-йодо-бензил-гуанин - лечение на невробластом.
- Соматостатин - Лечение на невроендокринни тумори.
Подобряване на външния лъчетерапия лъч
Подобряване на метода на фокусиране рентгенова на тумора, така че по-малко увреждане на нормална тъкан, ще позволи захранване на тумор-висока доза радиация.
Conformal лъчетерапия
В основата на този метод се състои радиотерапия триизмерна реконструкция на зоната за облъчване и планирането на облъчване така, че максималната доза радиация се понижи до целевата тумора (често с неправилна геометрична форма) и само малка - на нормални тъкани. Ранните клинични резултати показват, че използването на конформна лъчева терапия може да намали страничните ефекти на здрава тъкан и да доведе до по-висока доза на облъчване на обема (например, при рак на простатата).
Интензитет модулирани лъчетерапия
С този метод, лъчетерапия лъч се регулира така, че независимо от формата на дозата на тумора да се разпределят равномерно в него. По същество този метод може да се подобри ефективността на конформна радиотерапия и намаляване на излагането на радиация е особено чувствителни структури.
Интраоперативна лъчелечение
дозата на лъчение може да бъде подадена към туморната тъкан при визуален контрол по време на операцията. В тези случаи, след като подава голяма доза. Възможно предимство на такава бустер облъчване на (в допълнение към отдалечената фракционирано терапия) се заглажда недостатъци теоретично присъщи на единична високо облъчване.
Подобряване схеми радиотерапия фракциониране
Обикновено, туморната тъкан и критични, което ограничава възможността за безопасно увеличаване на дозата на облъчване, характеризиращ се с различна чувствителност (фракционира лъчетерапия.
Проучванията показват, бързото развитие на някои тумори: време за удвояване на броя на клетките, не надвишава 5 дни. Това означава, че продължителността на лечението на традиционната фракционна увеличение няма смисъл. Всъщност, цинични проучвания показват предимствата на ускорен курс на фракционирано терапия в продължение на 2 седмици (3 фракции на ден) в сравнение с традиционната 4-6-седмичен курс.
лъчесензитиращите
Използването на радиосенсибилизатори за подобряване на ефективността на облъчване на тумора, ако те избирателно се натрупват в тъканите.
Хипоксично клетъчни сенсибилизатори
Хипоксични туморни клетки са устойчиви на радиация. Въведение хипоксия клетъчни лъчесензитиращите теоретично би трябвало да повишат разрушителен ефект от излагането им. През последните години, като радиочувстрвителносредство започна да използва тирапаземин, но изследването на неговата ефективност, докато 1rodolzhaetsya.
синхронен химиотерапия
Химиотерапия, назначен с лъчетерапия, повишава разрушителен ефект върху тумор миналата. Този ефект може да се дължи на нарушение на ДНК oeparatsii процес химиотерапия или друг механизъм за повишаване на чувствителността на тумори на радиация. Допълнителни търсено оптимално режим на комбинирана химиотерапия, където ефективността се повишава ефект върху тумора без допълнителни по-чести странични ефекти.
С гледка лъчетерапия
Чрез забелязване радиотерапия разбере селективно облъчване на тумора от радионуклиди клетки, конюгирани молекули, а "работа" на тези клетки (белязани молекули).
радиофармацевтици
Облъчването на тумора чрез радиофармацевтици въз основа на съществуването на биологичните разлики между нормални и туморни клетки. Нанесете няколко вида радиофармацевтици, тяхното изследване е все още в ход.
Моноклонални антитела:
- Дискриминационно мощност е ограничена;
- недостатъчно изразена способност да проникне във вътрешността на тумора;
- миши антитела причиняват гостоприемник имунния отговор;
- използван при лечението на рак на яйчниците, рак на дебелото черво, мозъка умерен ефект;
- най-ефективен в В-клетъчен лимфом.
131I-MIBG:
- капан клетки на симпатиковата нервна система, синтезиращи катехоламини;
- включват клетки от невробластома, феохромоцитом;
- използвани като диагностични и терапевтични цели.
Видео :. RONTS.NOVEYSHIE лечение на рака на © ООД "Cyber живота"
Прогноза:
- лечение на меланома;
- Лечение на глиома, плоскоклетъчен карцином - EGFR прекомерна експресия на клетките.
Радионуклидите за наблюдение радиотерапия
За забелязване радиотерапия използване радионуклиди излъчващи - и-частици и Auger електрони. Въпреки радионуклиди излъчващи радиоактивни частици също излъчват фотони в определено количество гама-лъчи фотон радиотерапия роля в терапевтичния ефект е малък.
Полуживотът на радионуклида използва в радиофармацевтици, трябва да бъде достатъчно дълъг, за да позволи да бъде конюгиран лиганд и да действа върху туморни клетки. Клиничен опит наблюдение радиотерапия основно ограничена до използването на радионуклиди излъчващи частици, по-специално, 131I и в по-малка степен 90Y. Ползи 131I - неговата наличност, способността лесно да се конюгира и е широко известен за лекари.
Радиоактивните частици, излъчващи-частици, се характеризират с висока ефективност radiobiological, малка дължина на пътя, но те са трудно да се получи, и в допълнение, те имат кратък полуживот. Използването на тези радионуклиди все още не е преминал отвъд лабораторията, но предварителните резултати, получени в клиниката, са обнадеждаващи.
Радионуклидите, които излъчват Auger електрони, са установили, ограничено използване в цел лъчева терапия, която е свързана с дължина кратък път и необходимостта за етикетиране на ДНК.
Комбинирани терапии
Гледка радиотерапия използване радионуклиди излъчващи-частици, е неизбежно придружени от облъчване на цялото тяло, тъй като спецификата на радиоактивен недостатъчна (възможност за кръстосано свързване на здрави клетки) и радиоактивен циркулира в кръвта.
Тези характеристики прицелване лъчетерапия в момента се използват в рамките на невробластом чрез 131I-MIBG, комбинирането с общо облъчване на тялото или висока доза химиотерапия. Следващият етап на изследвания ще бъде комбинирано използване на радиофармацевтици и общо облъчване на тялото, или системна химиотерапия с трансплантация на стволови клетки при пациенти с В-клетъчен лимфом.
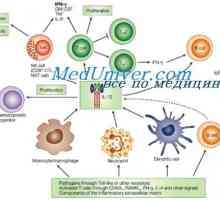 Интерлевкин-2 (IL-2). Интерлевкин-6, 12 (IL-6, 12)
Интерлевкин-2 (IL-2). Интерлевкин-6, 12 (IL-6, 12) Одобрени от FDA на ново лекарство за лечение на рак на кожата
Одобрени от FDA на ново лекарство за лечение на рак на кожата Инфекциозни заболявания могат да причинят рак
Инфекциозни заболявания могат да причинят рак Потенциалът на нови методи за диагностика и лечение на рак на пикочния мехур
Потенциалът на нови методи за диагностика и лечение на рак на пикочния мехур Разходите за лекарства против рак надхвърли $ 100 млрд годишно
Разходите за лекарства против рак надхвърли $ 100 млрд годишно Vismodegib sonidegib еднакво ефективно и рак на кожата
Vismodegib sonidegib еднакво ефективно и рак на кожата Те могат да бъдат установени лекарства против рак на базата на аспирин
Те могат да бъдат установени лекарства против рак на базата на аспирин Червеното вино има положителен ефект върху здравословно тегло
Червеното вино има положителен ефект върху здравословно тегло Нано- и светлина технологии в денталната медицина
Нано- и светлина технологии в денталната медицина Перспективи за развитие на клинична фармакология
Перспективи за развитие на клинична фармакология Ефект на сърдечни лекарства върху сърдечно-съдовата система
Ефект на сърдечни лекарства върху сърдечно-съдовата система Alveofakt (alveofakt) *. Силно пречистен естествен сърфактант, получен от белите дробове на едър…
Alveofakt (alveofakt) *. Силно пречистен естествен сърфактант, получен от белите дробове на едър… Акушерство и гинекология нова перспектива посоки на развитие на медикаментозното лечение на…
Акушерство и гинекология нова перспектива посоки на развитие на медикаментозното лечение на… Dalbavancin одобрени от FDA за лечение на кожни инфекции
Dalbavancin одобрени от FDA за лечение на кожни инфекции Испанските учени създават лек за цироза
Испанските учени създават лек за цироза Химическа нанотехнологиите: разработване на лекарства, контролирано светлина
Химическа нанотехнологиите: разработване на лекарства, контролирано светлина Nanogels за отглеждане на неврони
Nanogels за отглеждане на неврони Миниатюрни Holter наблюдават нови ™ пластир Holter
Миниатюрни Holter наблюдават нови ™ пластир Holter Nanotip да растат нови кръвоносни съдове
Nanotip да растат нови кръвоносни съдове Създадено с автоматично устройство, което помага да се разбере антибиотична резистентност на…
Създадено с автоматично устройство, което помага да се разбере антибиотична резистентност на… Сърповидноклетъчна анемия: предизвикателство за FDA
Сърповидноклетъчна анемия: предизвикателство за FDA