Леки вериги на имуноглобулин. организация на имуноглобулини
Видео: Организация и експресия на гени на имуноглобулин 2 тежка верига WMV V9
Съдържание
V-и С-област на лека верига приблизително равна на дължината. По този начин, за човешка капа верига V-област е изработена от части 107-113 на аминокиселина (като се излиза от N-края) и сметка С-област за останалите 107 остатъци. В тежката гама дължина на веригата от V-области е приблизително същата като региона С се състои от три линейно подредени един зад друг хомоложни региони С1, С2, С3 на подобна дължина, структурно хомоложна към С-региони на леката верига и един с друг.
V-регион на леката капа и ламбда вериги се различават един от друг, и те са различни от тези на тежките вериги, а V-региона на тежката верига са едни и същи за всички класове.
Видео: имунология - антитела соматични (VDJ) рекомбинация I
сред белите дробове окови, изолирани от различни патологични имуноглобулини, никой, подобно на другите. Смята се, че различни варианти антилялов има поне няколко хиляди. Въпреки това разнообразие, всички варианти на V-региона на капа вериги, се вписват в три главни подгрупи, разликите между протеините на всяка подгрупа е малък.
По същия начин е било възможно класифицирам V-област на веригата за ламбда, а в последно време и V-област тежки вериги.
аминокиселина замяна, зависи от разликите между V-домейни, като повечето от тях са групирани в няколко конкретни сайтове - така наречените горещи точки. В леки вериги, тези хиперпроменливи региони заемат позиции 25-35, 52-55 и 89-96, а тежката гама верига - 31-37, 86-91 и 101 -109. Тези остатъци са очевидно, участващи в образуването на активния център antitelVesma естествено в пептидните вериги на имуноглобулини местоположение vnutritsepevyh дисулфидни мостове.
Видео: Организация и експресия на имуноглобулинови гени 3

Всяка една от тези форми контур части с дължина на веригата от около 60 остатъци, и дясно и ляво от него, но има 20 остатъци. Така, основната част структурна единица верига е около 100 остатъци с дисулфиден мост. леки вериги на два от тях и те се срещат на V- и С-региони, както и техните четири гама вериги. В местните вериги всяка от тези части е сведена до минимум в отделна, относително независими компактен глобули домен (Putman, 1969).
Кой може да се счита за доказано схема IgG молекули структура, предложен от Porter (Porter, 1973). Съгласно тази схема, молекулата е изграден от L- и Н вериги присъедини mszhtsepevymi ди-сулфидни мостове. Когато протеолиза (например, трипсин или papaino.m), както е показано от Porter молекула разгражда в три части, две от които са идентични една на друга и имат активност на антитялото (Fab фрагменти). Те се състоят от лека верига и тежка верига половина. Третият фрагмент (Fc) се състои от С-крайната половина на тежките вериги.
Брой на връзки между тежките вериги варира и различни подкласове на човешки IgG е от две до пет.
IgA е намерена в две форми: - мономер подобно на молекула IgG, и полимер, се изгражда от две или повече мономерни единици. Макроглобулин IgM изработена от пет мономерни субединици наподобяващи молекула IgG.
Видео: Какво са имуноглобулин G? Какво ИМУНОГЛОБУЛИН G означава? ИМУНОГЛОБУЛИН G значение
Между различни по специфика антитела, принадлежащи към същия клас (подклас) и вида на изключително трудно за откриване на разлики в свойствата изключение за тяхната способност да взаимодействат с антигени. По този начин, на различни антигени, антитела структура е много подобна, с изключение на малка площ, в която те са в директен контакт с антигенните детерминанти.
антигени същите могат да варират вещества (протеини, полизахариди, синтетични химикали), които имат много различна конфигурация и изглежда се намира в много различни начини антигенни детерминанти.
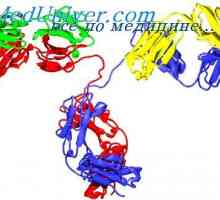 Класове имуноглобулини. Структурата на вериги на имуноглобулина
Класове имуноглобулини. Структурата на вериги на имуноглобулина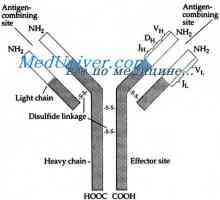 Имуноглобулин център гр. Активен център IgG
Имуноглобулин център гр. Активен център IgG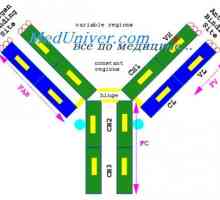 Имуноглобулин структура грама. домейни IgG
Имуноглобулин структура грама. домейни IgG Гъвкавост на имуноглобулин г и д. Гъвкавостта на видове имуноглобулини
Гъвкавост на имуноглобулин г и д. Гъвкавостта на видове имуноглобулини Контрол на образованието леки вериги на имуноглобулин. Гените леки вериги на антитела
Контрол на образованието леки вериги на имуноглобулин. Гените леки вериги на антитела Антигенността имуноглобулини. Антигенните детерминанти на антитела
Антигенността имуноглобулини. Антигенните детерминанти на антитела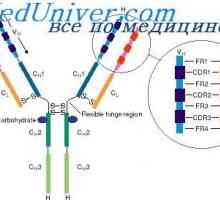 Локализация на гени леки вериги на антитялото. Причините за променливостта на леките вериги
Локализация на гени леки вериги на антитялото. Причините за променливостта на леките вериги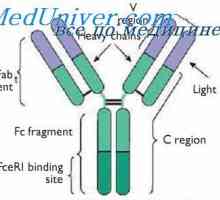 Вариабилните региони на антителни леки вериги. Променливи гени област
Вариабилните региони на антителни леки вериги. Променливи гени област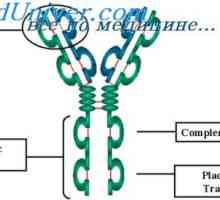 В ролите леки вериги на имуноглобулините. Ekstrauchastki антитела
В ролите леки вериги на имуноглобулините. Ekstrauchastki антитела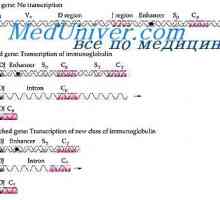 Получаване VC-имуноглобулин ген. Механизми асоциация V- и гени на антитела
Получаване VC-имуноглобулин ген. Механизми асоциация V- и гени на антитела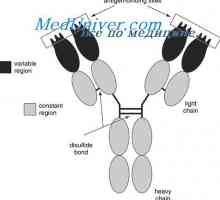 Образование тежка верига на имуноглобулин. Постоянната област на тежката верига на антитяло
Образование тежка верига на имуноглобулин. Постоянната област на тежката верига на антитяло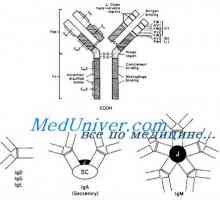 Entanglement тежката верига на антитялото гени. Гените на тежки вериги IgA
Entanglement тежката верига на антитялото гени. Гените на тежки вериги IgA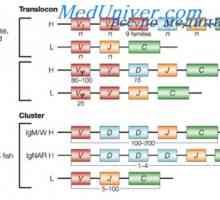 Транслокон имуноглобулини. Комбинирането v- и гени на антитела
Транслокон имуноглобулини. Комбинирането v- и гени на антитела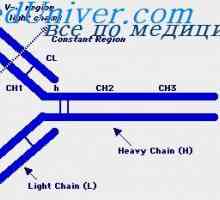 За свързване VH имуноглобулинови гени. Хромозома с гени на антитела
За свързване VH имуноглобулинови гени. Хромозома с гени на антитела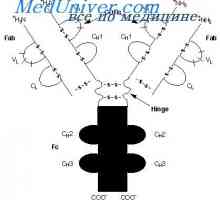 Разликите вариабилните области на антитела. Променлива подгрупа имуноглобулин
Разликите вариабилните области на антитела. Променлива подгрупа имуноглобулин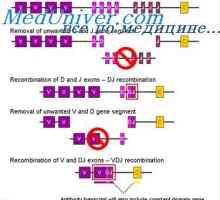 Разположение VC-ген. Включване антитяло генна активност
Разположение VC-ген. Включване антитяло генна активност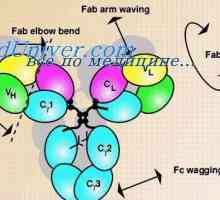 Променливите области на антитела тежки вериги. Гените за променливите райони тежки вериги
Променливите области на антитела тежки вериги. Гените за променливите райони тежки вериги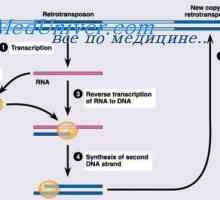 Синтез на имуноглобулин с тежка и лека верига. Uniform синтез на тежки и леки вериги на антителата
Синтез на имуноглобулин с тежка и лека верига. Uniform синтез на тежки и леки вериги на антителата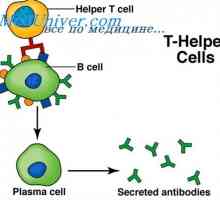 Прекурсори синтез л-верижни антитела. Ekstrapeptidy и тяхната функция
Прекурсори синтез л-верижни антитела. Ekstrapeptidy и тяхната функция Хибридизацията на иРНК и ДНК антитела. Локализация v- и гени в генома на имуноглобулини
Хибридизацията на иРНК и ДНК антитела. Локализация v- и гени в генома на имуноглобулини Ефектът върху фенотипа на генна активност. Алелните детерминанти на антитела
Ефектът върху фенотипа на генна активност. Алелните детерминанти на антитела