Основните химични компоненти на живите организми
Видео: Химичният състав на клетки
В тази статия ще се дава обобщена информация за структурата и функциите на основните химични компоненти на живите организми е необходимо за разбирането на основните предимства на материала. По-подробно в този раздел на материала се разглежда в хода на органичната химия и биохимия.Основна роля в структурата и активността на организми играе протеини (протеини) - азотни органични макромолекулни вещества, изградени от а-аминокиселини. Повечето от биологичните функции на протеините се извършва или с прякото им участие. Протеини - основен и необходим компонент на всички организми. В природата има около 10 10-10 12 различни протеини, отговорни за живота на повече от 2 милиона вида организми от всички степени на трудност - от вируси до хората.
протеини молекулно тегло в интервала 10000-1000000. Въпреки различията в структурата и функциите, елементарния състав на протеини варира леко. Протеини съдържат (% на база сухо вещество): 50 ... 55% въглерод, 21. ..23% кислород, 15 ... 17% от азот, 6 ... 7% водород, 0.3 ... 2 5% сяра. Съставът на отделните протеини са открити като фосфор, йод, желязо, мед, селен и друг макро и микроелементи в различни, често много малки, количества.
Структурата на протеините на живи организми и включва 19 аминокиселини, в които амино и карбоксилни групи са прикрепени към същия въглероден атом и пролин имино киселина. Всички тези киселини се наричат протеиногенни (често пролин не се изолира и се включват двадесет протеиногенни амино групата). Даваме името на протеиногенни аминокиселини и техните латински букви и една буква наименования: аланин (Ala, А), аргинин (Arg, R), аспарагинова киселина (Asp, D), аспарагин (Asn, N), валин * (Val, V), хистидин (His; Н), глицин (Gly, G), глутаминова киселина (Glu, Е), глутамин (Gin, Q), изолевцин * (He, I), левцин * (Leu, L), лизин * (Lys, K ), метионин * (Met, М) пролин (Pro, P), серин (Ser, S), тирозин (Tyr, Y), треонин * (Thr, T), триптофан * (Trp, W), фенилаланин * ( Phe, F), цистеин (Cys, с) (символът * в споменатите последователности са така наречените основни аминокиселини, които синтезират само за растения и не синтезира в човешкото тяло). Ако сумата от тези аминокиселини в храната е недостатъчна, за нормалното развитие и функциониране на човешкото тяло е нарушен.
Аминокиселините - на хетерофункционални съединение. Молекулата на аминокиселина съдържа множество функционални групи: амино група -NH2, карбоксилна група -СООН и радикалите -R, които имат различна структура:

Във воден разтвор при рН стойности, близки до неутралните аминокиселини съществуват като цвитерйони NH3 + CHRCOO-.
Всички аминокиселини, с изключение на най-простият аминооцетна киселина (глицин) имат асиметричен въглероден атом, - C * - и могат да съществуват като два оптични изомери (енантиомери): L- и D-. Съставът на всички изследвани протеини сега включва само аминокиселина L-серия, в която, когато се гледа асиметричен атом от Н атом, група -NH3 +, -СОО" и радикалът -R разположени на часовниковата стрелка. Обикновено протеини (протеини) се състоят само от остатъци belkov- сложни протеини (proteid) включва протеин (апопротеин) и не-протеин (простетични групи) части.
Всеки протеин има своя собствена, присъща подреждане на аминокиселинна последователност. аминокиселинни остатъци, свързани с пептид или амид (-CO-NH-) връзка между а-амино и а-карбоксилни групи. Според броя на остатъци на аминокиселини, участващи в изграждането на пептида, олигопептиди разграничение (три-до декапептиди) и полипептиди. Имената на пептидите образуват съответния а-амино киселини и имена, участващи в образуване на пептидна връзка поради карбоксилни групи аминокиселини, се получава -ил наставката. В края на тази аминогрупа с свободен водород е обозначен с Н, и на края с свободна карбоксилна група - символ ОН, например: H-Val-Ser-OH - valilserin.
Протеин като биологично значим структура може да бъде или единична полипептидна или няколко полипептиди, представляващи Получената нековалентни взаимодействия един комплекс.
изключителна собственост протеин - самоорганизиращи се структури, т.е. способността за спонтанно произвеждат определена присъща само този протеин пространствена структура. Установено е, че всички протеини са изградени на същия принцип и имат четири нива на организация: първични, вторични, третични и някои от тях - и четвъртична структура.
Последователността на аминокиселинни остатъци в полипептидната верига на съединението се нарича първичната структура на белтъка (Фиг. 1). Това е линейна верига от аминокиселини (полипептид), подредени в последователност с ясно генетично обусловена въртене и свързани помежду си чрез пептидни връзки.

Фиг. 1. Първична структура на протеина
Към днешна дата, аминокиселинните секвенции, определени за няколко хиляди различни протеини. Записване на протеинова структура под формата на подробни структурни формули тромави и не интуитивен. Затова използвайте стенография - трибуквен или единичен код. При запис в аминокиселинната последователност на полипептид или олигопептидни вериги използват съкратените символи предполага, освен ако не е специално посочено, че а-амино групата в ляво и а-карбоксилна група - отдясно.
Вторична структура по-долу структура, която образува полипептидна верига. Вторична структура има най на протеините, обаче, не винаги са навсякъде полипептидната верига. Благодарение на водородни връзки между пептидни групи и - аминокиселинни остатъци придобиват спирална форма полипептидни вериги (а - структура). Водородни връзки могат да осигурят съединение и прилежащите (удължена) полипептидни вериги за образуване на други типове вторична структура - структура (структура на сгънатия лист, сгънати слой).
Информация за редуване на аминокиселинни остатъци във веригата на полипептид (първична структура) и присъствието на протеин молекула spiralized, пластове и разстройства техни фрагменти (вторичната структура) не дава пълна картина на всяка от обема, нито форма, нито дори на относителните позиции на участъци полипептидна верига във връзка един с друг. Тези характеристики на протеинова структура установи при изучаването неговата третична структура, която се отнася до общо място в пространството на молекулите на една или повече полипептидни вериги, свързани чрез нековалентни връзки.
Сред връзките, които задържат третичната структура, трябва да се отбележи:
а) дисулфиден мост (-S-S-) между два цистеинови остатъци;
б) естер мост (между карбоксилни и хидроксилни групи);
в) сол мост (между карбоксилната група и амино група);
ж) водородни връзки между групите -СО- и -NH.
Третична структура обяснява спецификата на протеиновата молекула, неговата биологична активност.
По-голямата част на пространствената организация на протеин третична структура завърши, но за някои от протеини с молекулно тегло по-голямо от 50 100 000 ... изградена от няколко полипептидни вериги е характерно четвъртична структура. Същността на тази структура е да се комбинират няколко полипептидни вериги с първична, вторична и третична структура на един комплекс
Унищожаването на връзки, които стабилизират кватернерни, третичен и вторичната структура, което води до дезориентация и конфигурация на молекулата на протеин, агрегация, изменение на физичните свойства (разтворимост, вискозитет) и химическа активност, намаляване или пълна загуба на биологичната функция се нарича протеин денатуриране. Първичната структура, а оттам и на химическия състав на белтъка не се променя.
SV Макаров, TE Никифоров, NA Козлов
Споделяне в социалните мрежи:
сроден
 Биохимия на кръвта, на панкреаса с панкреатит
Биохимия на кръвта, на панкреаса с панкреатит Определенията в ембриологията. Концепцията за развитие в ембриология
Определенията в ембриологията. Концепцията за развитие в ембриология Превенция на атеросклероза. свойства на аминокиселини
Превенция на атеросклероза. свойства на аминокиселини Разпределението на протеини. Физиология разбивка регулиране протеин
Разпределението на протеини. Физиология разбивка регулиране протеин Физиологията на хранене. диета
Физиологията на хранене. диета Повърхностно ефекти на газовите мехурчета. Ефектът на газови мехурчета на липопротеини
Повърхностно ефекти на газовите мехурчета. Ефектът на газови мехурчета на липопротеини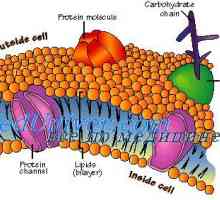 Мембрана на клетките. Структурата на клетъчната мембрана
Мембрана на клетките. Структурата на клетъчната мембрана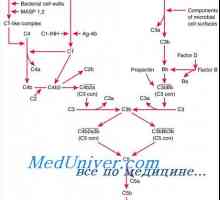 Механизми на действие на антитела. Комплемента система активиране на антитела
Механизми на действие на антитела. Комплемента система активиране на антитела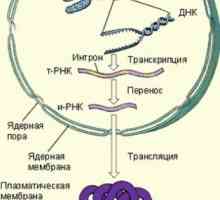 Стъпки на синтеза на протеини в тялото
Стъпки на синтеза на протеини в тялото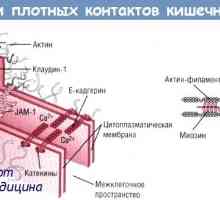 Чревната силно съединителна структура, структура
Чревната силно съединителна структура, структура Рано фоликул. Фактори на транскрипцията и зона пелуцида
Рано фоликул. Фактори на транскрипцията и зона пелуцида Протеините в храни
Протеините в храни Физиологичното значение на основните компоненти на храната
Физиологичното значение на основните компоненти на храната Химическа специфичност в биологичната еволюция
Химическа специфичност в биологичната еволюция Биологични обекти в областта на биотехнологиите
Биологични обекти в областта на биотехнологиите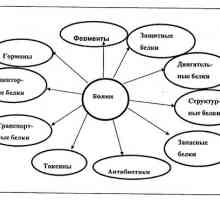 Основните химични компоненти на живите организми. различни фактори,
Основните химични компоненти на живите организми. различни фактори,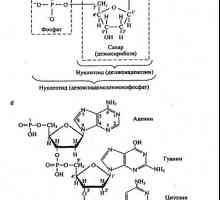 Основните химични компоненти на живите организми. липиди
Основните химични компоненти на живите организми. липиди Аминокиселините са основните "изграждащи блокове" за синтеза на тъканни специфични…
Аминокиселините са основните "изграждащи блокове" за синтеза на тъканни специфични… Биолозите са се научили как да синтезира протеини с всяка желана структура
Биолозите са се научили как да синтезира протеини с всяка желана структура Каква е цитоскелет?
Каква е цитоскелет? Кърлежи - най-упорити животни
Кърлежи - най-упорити животни